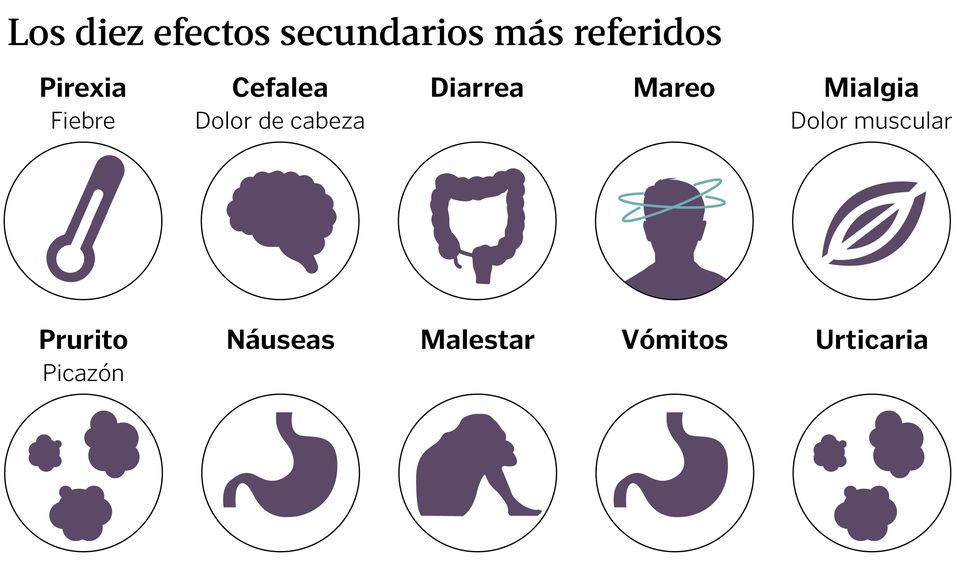
De la fiebre a la urticaria, ¿cuáles son los efectos secundarios más notificados de los medicamentos?

EL BOTIQUÍN
Finalizados los ensayos clínicos y con un fármaco ya en el mercado, los profesionales sanitarios y los ciudadanos son esenciales para detectar reacciones adversas desconocidas; empieza un proceso conocido como farmacovigilancia
22 may 2024 . Actualizado a las 14:29 h.Más graves o menos graves, más frecuentes o menos, todos los medicamentos tienen efectos adversos; cualquiera que haya curioseado un prospecto, lo sabe. «El mejor medicamento que hay es el que no se toma», se dice entre los círculos farmacéuticos, argot para entender que ningún compuesto es inocuo. Tragarse una pastilla implica aceptar un riesgo. Pero la inmensa de mayoría de las veces es tan pequeño que lo aceptamos sin ni siquiera medirlo. ¿Alguien va a renunciar a tomarse un paracetamol que alivie el malestar de un resfriado porque exista una posibilidad entre 10.000 de que suframos una erupción cutánea?
La mayoría de los efectos adversos que se nos describen en los medicamentos han sido estudiados en los ensayos clínicos que todos los fármacos deben pasar antes de poder ser comercializados. En una primera fase, se comprueban los efectos que causa un nuevo medicamento en personas sanas; en una segunda, se empieza también a probar en los pacientes a los que va dirigido; en la tercera, ya con unos márgenes de seguridad demostrados, se busca ampliar la muestra. Pero existe una cuarta fase, cuando el producto ya está disponible en las farmacias, en la que todos participamos, en la que nos incorporamos al estudio. Es la llamada farmacovigilancia y toda la población está llamada a participar. Nos convertimos en vigilantes de nuevas posibles reacciones adversas.
«La misión de la farmacovigilancia es la de seguir haciendo un seguimiento durante toda la vida del medicamento. Los ensayos clínicos tienen limitaciones, hay reacciones adversas que no se van a poder detectar por el simple hecho de que es imposible probar el medicamento en todas las personas a las que va dirigido. Los laboratorios lo prueban sobre un número de pacientes, pero a nivel estadístico va a ser imposible detectar determinadas reacciones», comenta Alicia Gil Valiño, responsable del Centro de Farmacovigilancia de Galicia. Por eso es fundamental —y obligatorio por ley— que los profesionales sanitarios de toda España reporten a los diferentes centros autonómicos de farmacovigilancia las sospechas de posibles reacciones adversas que les comuniquen sus pacientes, datos que serán puestos en conocimiento también de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Del mismo modo, cada paciente puede acceder a la plataforma Notificaram en la que puede explicar su caso, que será debidamente estudiado.

De tu casa a la EMA
En el año 2023, las denuncias registradas por los ciudadanos de la Unión Europea provocaron que las fichas técnicas de seis medicamentos ya en el mercado fuesen modificadas por nuevas reacciones adversas. Un ejemplo de ellos es la dapagliflozina, una molécula empleada para tratar la diabetes. Gracias a la farmacovigilancia se detectó que podía provocar fimosis que, en algunos casos, requería circuncisión. Otras de las sospechas puestas en conocimiento de las distintas agencias por parte de sanitarios y ciudadanos están a día de hoy siendo sometidas a estudio. En la EMA se investiga todavía —tras los informes recibidos desde la agencia del medicamento francesa— si la pseudoefedrina, un popular principio activo de muchos antigripales, puede provocar daño cerebral en pacientes con determinadas patologías previas.

«La pseudoefedrina es un ejemplo, pero hay más. Otro caso que salió en el año 2024 es sobre el uso del valproato en varones que quieren tener hijos, la AEMPS comunicó que se había relacionado con un aumento del riesgo de trastornos del neurodesarrollo en niños y niñas cuyos padres fueron tratados con este medicamento», recuerda Alicia, que comenta que la farmacovigilancia «no termina nunca».

El del valproato —un medicamento que se utiliza para tratar los episodios de manía en pacientes psiquiátricos— es un buen ejemplo para entender algo a lo que se refiere José Antonio Valcárcel, jefe del servicio de Calidade e Seguridade de Medicamentos e Productos Sanitarios del Sergas: «Los efectos adversos pueden aparecer después de muchísimos años». El responsable del servicio fija en la crisis de la talidomida, ocurrida entre 1957 y 1963, como el inicio de la farmacovigilancia moderna; de cómo la entendemos hoy en día. Un fármaco destinado a combatir las náuseas en las embarazadas y que se acabó probando que ocasionaba malformaciones en los fetos décadas después. «Fue uno de los puntos claves para el surgimiento de los centros de farmacovigilancia, sus efectos adversos aparecieron en las pacientes pasados veinte años debido a una medicación que se tomaron cuando estaban embarazadas», expone. Con esto en mente se trabaja todos los días en el centro gallego de farmacovigilancia, ubicado en el edificio del Servizo Galego de Saúde en San Lázaro (Santiago de Compostela), donde el año pasado recibieron 1.290 notificaciones de sospechas de posibles efectos adversos procedentes de los profesionales sanitarios, la ciudadanía y de la propia industria.
¿Cómo denunciar la sospecha de una reacción adversa?
Antiguamente, el centro de farmacovigilancia gallego recibía los informes sobre posibles sospechas en formato físico en lo que se conocía como «tarxeta amarela». Aunque sigue existiendo y puede todavía encontrarse en los centros de salud, ha quedado en desuso. «El cambio de la tarjeta amarilla, que era un soporte físico, a los sistemas de notificación por los medios telemáticos ayudó mucho. Ya no hay que cubrir un cartón, meterlo en un sobre, escribir la dirección, que si sello o no, hacer que llegue... Parece que no, pero toda esa gestión lleva su tiempo. Con la informática, la información fluye mejor. El profesional hace un click y, al momento, la tenemos aquí, sin necesidad de esperar a que llegue en formato físico. Y por supuesto, pone mucho más fácil que toda la ciudadanía aporte. Esto es algo muy importante cuando se trata de reacciones adversas graves y agiliza las posibles soluciones», comenta Valcárcel asegurando que también supone un ahorro importante desde el punto de la gestión. Se han dejado de imprimir miles de esas tarjetas amarillas, de las cuales se acababan usando una cantidad ínfima.
Aunque en el total de avisos que se lanzan en la plataforma, todavía son mayoritarias las que son remitidas por profesionales clínicos, cada vez son más las que proceden de la ciudadanía. Sabemos que las mujeres notifican más que los hombres, o que los fármacos más utilizados —un ejemplo es el paracetamol— se llevan un buen puñado del pastel. El covid fue sin duda un punto de inflexión, desde la pandemia se multiplicaron por dos las notificaciones recibidas. ¿Pero qué hay que hacer para notificar un posible efecto de un fármaco?
«Es importante notificar, pero sobre todo notificar con calidad. Cuanta más calidad haya en la notificación, mejor se va a detectar», Adelanta Gil. Por eso, desde notificaram.es se ofrece un cuestionario cerrado. «La plataforma de comunicación cuenta con un cuestionario, donde ya hay un espacio para cubrir campos como el del nombre del medicamento, el lote, datos de la persona. Una serie de cosas que permiten trabajar los datos de una manera mucho más sencilla. No es que recibamos un correo electrónico en el la gente nos vaya a contar su película. Es un formulario que se contesta en base a unas opciones que ya te da el propio sistema», razona José Antonio Valcárcel. Todos los datos que facilitemos son confidenciales y solo podrán ser manejados por las personas que conforman el grupo de farmacovigilancia.
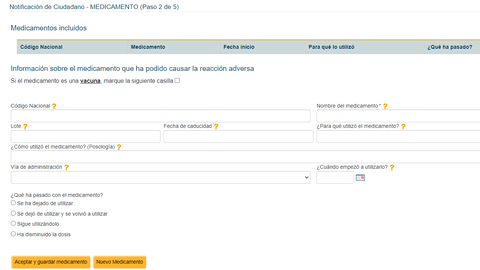
Así, los pasos para notificar a través de la web que empiezan en este enlace serán los siguientes:
- Paso 0: elegir la comunidad autónoma a la que pertenecemos en un mapa, una vez seleccionada, indicaremos que se trata de una notificación ciudadana.
- Paso 1, datos del paciente: deberemos indicar nuestro nombre, apellidos, sexo y grupo de edad. También nuestro peso y altura. Además podremos informar si la reacción adversa la hemos padecido nosotros o si ha sido otra persona. Se nos preguntará si padecemos alguna otra enfermedad.
- Paso 2, datos del medicamento: en este paso tendremos que indicar el código nacional del medicamento que está presente en el envase del producto (son seis dígitos), también el nombre del fármaco, el lote, su fecha de caducidad, para qué lo hemos utilizado y la posología usada. También la vía de administración (oral, por ejemplo) y cuándo comenzamos el tratamiento. Del mismo modo, habrá que indicar qué hemos hecho ante la reacción adversa, es decir, si lo hemos dejado, seguido con él o disminuido la dosis.
- Paso 3, interacciones con otros medicamentos: en este paso se nos pide indicar si en los últimos tres meses hemos estado tomando algún otro fármaco. Si la respuesta es que sí, daremos los mismos datos sobre él que ya dimos en el paso anterior.
- Paso 4, datos de la reacción: aquí se nos dan varias opciones ya cerradas para indicar la gravedad de la reacción adversa siendo el peor escenario que la vida del paciente haya corrido peligro. A continuación describiremos cuándo empezaron los síntomas y cuándo acabaron, así como el estado actual de la persona afectada.
- Paso 5, datos del remitente: por último, tendremos que dar una serie de datos sobre la persona que realiza la notificación. Se le pedirá su consentimiento para que, en caso de que se necesite más información, se pongan en contacto con usted. Pulsaremos el botón de enviar y el proceso se habrá completado.
Toda la información aportada será registrada en las bases de datos autonómicas de la aplicación FEDRA (Farmacovigilancia Española Datos de las sospechas de las Reacciones Adversas) y de allí, una vez procesada, pasará a formar parte de los datos de la agencia española. La AEMPS los remitirá a su homólogo europeo (PRAC), que incorporará los datos en las bases de datos de la EMA (EudraVigilance) y de la OMS (VigiBase).
El colapso del covid: bulos, reportes masivos y farmacovigilancia
A la hora de destacar un momento especialmente destacado de su trayectoria como vigilantes de fármacos, ambos lo tienen claro: la vacunación masiva de la población frente al covid-19. Si en el año 2020 el total de notificaciones presentadas fue de 21.058, al año siguiente ese número se elevó hasta las 71.710 sospechas. «Hubo un bum tremendo, por eso se pidió evitar notificar síntomas como el del dolor en el brazo. Cuando recibes miles de notificaciones con lo mismo, deja de tener demasiado sentido. No hay que olvidar para que sirve la farmacovigilancia: busca aumentar la seguridad en el uso de los medicamentos y, en consecuencia, la seguridad de los pacientes. Con las vacunas covid se detectaron reacciones adversas nuevas y la información fue publicada en los medios de comunicación; que parecía que había problemas con ciertas vacunas. En Galicia llegamos a más 3.000 notificaciones sobre sospechas. Separábamos entre las graves y las que no eran graves, dándole prioridad a las graves, que tiene un período de tiempo más corto para hacer la evaluación», explica Alicia Gil.

Precisamente, y a raíz de la reciente desaparición de la vacuna de AstraZeneca del catálogo de ofertas de la AEMPS, se han podido ver algunas de las aportaciones de la farmacovigilancia en materia de vacunas. Las famosas trombosis que provocaba en muy raras ocasiones esta vacuna fueron detectadas durante la farmacovigilancia e incorporadas a su ficha técnica en el año 2021, pese a que desde la prensa británica se esté indicando que el laboratorio ha reconocido por primera vez estos efectos en las últimas semanas.