Así es la metástasis: «El ambiente ayuda al tumor a seguir creciendo»

ENFERMEDADES

La localización del tumor primario puede definir en qué partes del cuerpo podría llegar a hacer metástasis
06 feb 2023 . Actualizado a las 11:53 h.El diagnóstico de un cáncer es uno de los que suelen provocar más miedo. A pesar de los avances en la detección y los tratamientos, que están mejorando la supervivencia y el pronóstico en cada vez más tipos de tumores, todavía tendemos a asociar esta enfermedad a la muerte. Y esto es especialmente cierto si hablamos de un cáncer que ha hecho metástasis. No en vano: como señala la investigadora Ángela Nieto, del Consejo Superior de Investigaciones Científicas (CSIC), este proceso es responsable de más del 90 % de las muertes por cáncer.
La metástasis es el proceso por el cual el cáncer puede propagarse desde su localización inicial hacia otras partes del cuerpo. En su libro Egoístas, inmortales y viajeras (Paidós), el investigador Carlos López-Otín explica que «el objetivo principal del viaje es encontrar nuevos lugares en los que el espacio, los nutrientes y el oxígeno no estén limitados, lo cual acaba produciéndose en el tumor primario como consecuencia de su crecimiento excesivo y abusivo».
Así, las células parten a través de los vasos sanguíneos o los canales linfáticos cercanos al tumor y llegan a otros órganos para colonizarlos. Este proceso es, en realidad, altamente complejo. Conlleva distintas etapas en las que la célula maligna ha de sufrir transformaciones para sobrevivir en una región nueva. Dada esta dificultad, no todas las células tumorales pueden, hipotéticamente, llegar a ser metastásicas. Esta es una buena noticia, ya que, como señala López-Otín, «una vez que las células tumorales alcanzan el torrente sanguíneo y se extienden por el cuerpo dando lugar a las temidas metástasis, la progresión tumoral es prácticamente irreversible a largo plazo en la mayoría de los casos».
Cómo funciona la metástasis
Para que las células cancerosas puedan salir de su localización original y trasladarse a través del cuerpo, necesitan ir reposicionándose alrededor de células adyacentes. Esto lo logran «arrastrándose» mediante la reestructuración de su citoesqueleto y la adhesión de la célula a otras y a la matriz extracelular. Para ello, se tiene que alterar un grupo específico de genes que le permiten desprenderse del tumor. De esta forma, se van trasladando hasta toparse con la membrana basal, una barrera que rodea a los diferentes órganos y tejidos. Para cruzar esta barrera, la célula cancerosa deberá secretar enzimas que le permitan degradar o perforar la membrana.
Una vez fuera, las células pueden moverse a través del cuerpo de varias maneras. Por ejemplo, entrando al torrente sanguíneo, algo que logran comprimiéndose entre las células que componen los vasos. En la sangre, las células tumorales viajan hasta detenerse en un tejido para empezar a crecer, formando un nuevo tumor.
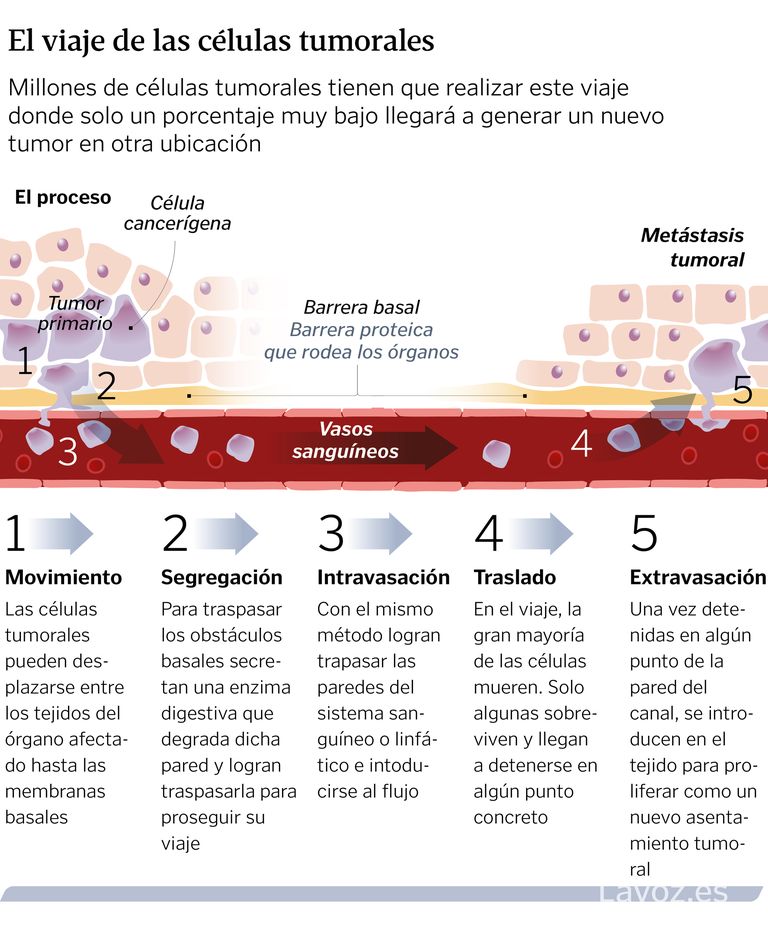
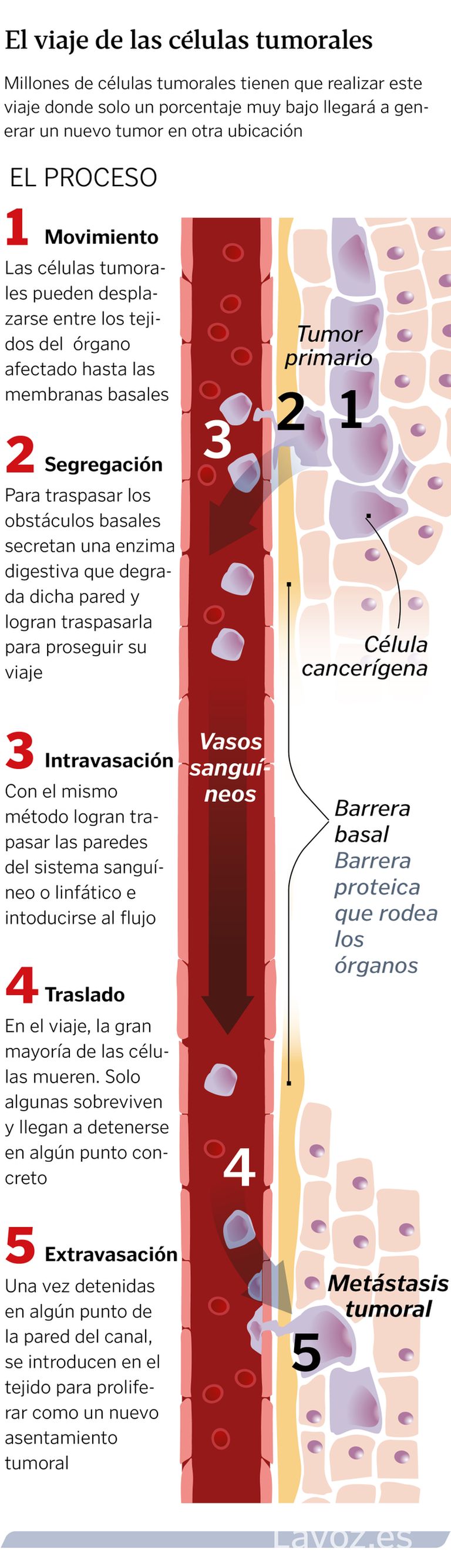
Todo esto no es sencillo. «Las células migrantes necesitan desarrollar alguna estrategia que les permita invadir los tejidos adyacentes y penetrar en el torrente sanguíneo, sobrevivir al viaje de diseminación, defenderse del sistema inmunitario, detenerse en el lugar preciso para invadir otro territorio, abandonar los vasos sanguíneos por los que han viajado, penetrar en la nueva localización y crecer allí hasta lograr crear una nueva colonia cancerosa», señala en este sentido López-Otín.
Todos estos pasos constituyen en conjunto lo que se conoce como cascada metastásica. A través de ella, las células del tumor primario adquieren la capacidad de moverse, y luego vuelven a transformarse en células estáticas (epiteliales) cuando anidan en otro órgano.
Para lograrlo, «las células tumorales que aspiran a ser metastásicas tienen necesariamente que acumular nuevas mutaciones en su genoma, o amplificar algún oncogén adicional, o inactivar otros supresores tumorales, o sufrir diversos cambios epigenéticos para afrontar las muchas demandas que conlleva un viaje celular de esta naturaleza», detalla López-Otín. De lo contrario, la célula cancerosa puede morir de varias maneras: puede ocurrir al desprenderse de la superficie de otras células, o al trasladarse a través de los vasos sanguíneos, ya que son células sobredimensionadas en su tamaño y se pueden atascar. También es posible que sean detectadas y destruidas por el sistema inmunológico.
Como explican desde la Universidad Emory, en Estados Unidos, el proceso de la metástasis es muy ineficiente, sin embargo, «millones de células se pueden separar de un tumor diariamente. Aunque solo una pequeña fracción de las células que se desprenden de un tumor tienen la habilidad de sobrevivir y formar un nuevo tumor, el gran número de intentos significa que un crecimiento a distancia es probable en algún momento».

Una vez que la célula tumoral metastásica se haya establecido en un nuevo ambiente, necesitará formar una colonia, modificando la matriz extracelular en ese ambiente para que sea favorable a su expansión. Esto es importante, ya que el nuevo tejido va a ser significativamente distinto al de la localización inicial del tumor y, en general, será inhóspito para la supervivencia de este.
«La célula metastásica está en constante evolución y esa evolución, además, está dictada por dónde aterriza. Si tiene que adaptarse al cerebro va a evolucionar de una manera diferente que si tiene que adaptarse al hígado. Como son células alteradas, tienen mucha facilidad para encontrar maneras óptimas de adaptarse al sitio en el que están creciendo», observa el investigador Manuel Valiente, Jefe del Grupo de Metástasis Cerebral del Centro Nacional de Investigaciones Oncológicas (CNIO).
Rutas de la metástasis
La diseminación de un tumor a órganos distantes puede ocurrir por tres rutas:
- Hematógena (circulación sanguínea)
- Sistema linfático
- Transcelómica (a través de la pared corporal a las cavidades abdominales y en el pecho)
La ruta más común es el sistema circulatorio. Los vasos linfáticos constituyen una ruta a los ganglios linfáticos locales y frecuentemente, en una segunda etapa, las metástasis se diseminan a través de la sangre. La diseminación transcelómica es poco común y parece estar limitada a los mesoteliomas y a los carcinomas ováricos.
Al viajar a través de los vasos, las células pueden ir hasta sitios lejanos respecto del tumor primario. Allí, crecen en el tejido hasta formar un nuevo tumor. En este proceso, el tumor promueve el crecimiento de vasos en torno a él y hacia su interior, para recibir irrigación y seguir creciendo. La formación de nuevos vasos sanguíneos se conoce como angiogénesis, y el crecimiento de vasos linfáticos, como linfangiongénesis. Ambos procesos son cruciales para estos tumores, por lo que los fármacos diseñados para inhibirlos pueden ser útiles para los pacientes con metástasis.
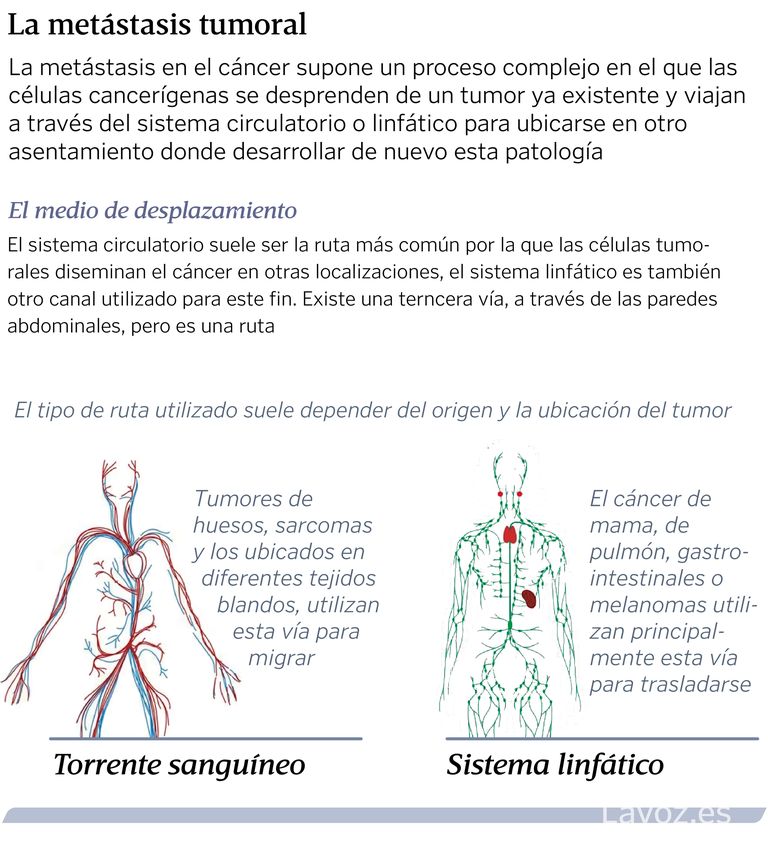

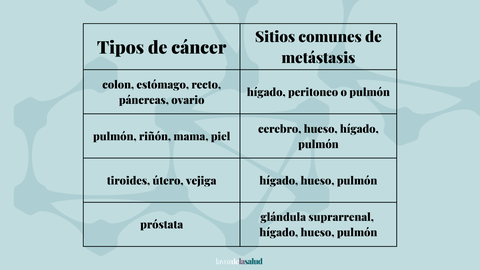
¿Por qué la metástasis arraiga en un órgano u otro? En gran medida, la respuesta a esta pregunta se desconoce. Esto complica las posibilidades de hacer un diagnóstico temprano o una prevención de la metástasis en muchos casos. «No es fácil entender por qué ocurre metástasis en un órgano o en otro. Ahora mismo no tenemos biomarcadores que permitan predecir esto», apunta Valiente. Lo que sí se sabe es que determinados tumores tienen mayores probabilidades de desarrollar metástasis en unos sitios concretos que en otros.
Tratamiento
Aunque existen tratamientos para la mayoría de los tipos de cáncer metastásico, es cierto que suelen ser tratamientos destinados a controlar la enfermedad o retrasar su avance. En este sentido, se busca extender la supervivencia y mejorar, en la medida de lo posible, la calidad de vida de los pacientes aliviando sus síntomas. El tipo de tratamiento elegido dependerá principalmente de dos factores: el tipo de cáncer primario del que se ha desprendido la metástasis y el lugar del cuerpo en el que esta se ha diseminado.
Los últimos avances de la investigación apuntan hacia estas variables para formular nuevos fármacos. «Lo que se está estudiando es que, en la metástasis, el ambiente establece unas ayudas que el tumor necesita para seguir creciendo. Entonces, ahora hay fármacos o proyectos para intentar aislar al tumor, para que no tenga esa ayuda. Eso es lo que hace la inmunoterapia, activa a las células del sistema inmune para que ataquen al tumor. Estos no son fármacos generalistas como la quimioterapia, que suele estar indicada en el cáncer porque mata a células que se dividen. Aquí, lo que estamos empezando a dibujar son nuevas posibilidades terapéuticas que serán específicas para el órgano en el que se desarrolla la metástasis», explica Valiente.
En este sentido, será crucial de cara al futuro entender el metabolismo de las células tumorales para quitarles el acceso a estos recursos. «Las células cancerígenas aprovechan los nutrientes de una manera anormal porque necesitan crecer a lo loco. Lo que se está viendo ahora es que si la célula crece en el cerebro, tomará diferentes "comidas" que si está en el hueso. Entonces, estudiar los procesos metabólicos dependiendo del órgano en el que crece la célula da muchas esperanzas de que poco a poco vayan apareciendo estrategias para tratar las metástasis», dice Valiente, y subraya el hecho de que las metástasis no se pueden tratar de la misma forma que el tumor primario del que han salido.
¿Por qué es tan importante el rol del metabolismo celular en la metástasis? «El metabolismo es el proceso biológico que conecta los nutrientes, básicamente aquello que ingerimos y aquello que producimos a través de la microbiota intestinal, con la célula, creando un producto metabólico. Al final, el metabolismo es una especie de motor de la célula. Y en lo que refiere a la metástasis, lo que se ha visto es que las células que pueden cambiar y adaptarse son las más propensas a desarrollar esta transformación metastásica, porque pueden adaptarse a cada uno de los deafíos de la cascada metastásica. Las adaptaciones metabólicas son un requisito para que se den estos cambios en las células cancerosas. Es decir, las células cancerosas necesitan un metabolismo distinto en cada una de esas etapas. Aquí tenemos una ventana de oportunidad para interceptar el proceso metastásico en todos esos distintos niveles atacando a esos metabolismos», explica Sarah-Maria Fendt, investigadora principal del VIB KU Leuven Center for Cancer Biology, en Bélgica.
«Ahora estamos investigando qué procesos metabólicos podemos interceptar para frenar la formación de metástasis. Esto es mucho más específico que los abordajes tradicionales, que atacan a la proliferación de una forma más general; pensemos en la quimioterapia. Podemos hacer tratamientos más específicos buscando formas de atacar al metabolismo de las células que están circulando, o las que están entrando a un órgano e intentando crecer en este nuevo ambiente. Así, actuamos de una manera mucho más selectiva. Atacar al metabolismo que atañe a la formación de la metástasis es muy importante porque podríamos frenar la capacidad de esas células de adaptarse, volviéndolas vulnerables», detalla Fendt.
Esto permitiría frenar la metástasis en etapas más tempranas, mejorando el pronóstico. Mientras tanto, a día de hoy, el proceso sigue siendo, en la mayoría de casos, incurable. «Donde hay metástasis se crea un ecosistema en el que hay muchas especies de células que nunca han interactuado entre sí y que además interactúan con el tumor. Aquí, lo que se está dibujando es una imagen que ya no es tan sencilla como tener un tumor y atacar a las células de ese tumor», observa Valiente.
«Una vez que el paciente tiene metástasis, hemos pasado de una enfermedad local a una enfermedad sistémica. Tenemos lesiones en múltiples órganos, es difícil de reseccionar. Esto implica un mal pronóstico para el paciente. Entonces, obviamente, de cara al paciente, la prevención sería lo mejor. Tenemos que pensar en fármacos para prevenir esta etapa sistémica, o bien que puedan ir como balas a cualquier órgano y atacar a la metástasis allí donde esté», explica Fendt.
Así, por ejemplo, su laboratorio está estudiando el metabolismo lipídico en el cáncer de mama. «La grasa es metabolizada por las células metastásicas y esta les permite ser mucho más efectivas, lo que explicaría el hecho de que el riesgo de metástasis, en pacientes de cáncer de mama, aumenta si tienen obesidad o sobrepeso. Tener un tratamiento que interrumpa este metabolismo de los lípidos podría ser muy interesante», señala la investigadora.
Cuando la metástasis llega al cerebro
«Las metástasis en el cerebro, cuando las células del cáncer van al sistema nervioso, son la causa más frecuente de afectación cerebral en el cáncer», explica la doctora María Martínez García, jefa de sección de Neuro Oncología y Unidad de Investigación Clínica del servicio de Oncología Médica del Hospital del Mar. Esto sucede en casos específicos. «Los tumores que más frecuentemente dan estas metástasis son el cáncer de pulmón, el cáncer de mama y el melanoma», enumera la experta.
En estos casos, los pacientes suelen debutar con síntomas cognitivos. «Desde crisis epilépticas hasta pérdida de fuerza y lo más típico suele ser un dolor de cabeza que se acompaña de signos de gravedad, que te despierta por la noche, que se acompaña de vómitos. O gente que viene a Urgencias porque no puede hablar bien o mover una parte del cuerpo», describe Martínez.
«Lo particular del cerebro es que es un órgano muy privilegiado, con unas funciones muy importantes. Por tanto, el abordaje que hacemos en el cerebro difiere un poco de las metástasis en otros órganos. El cerebro está muy bien protegido para que nuestras funciones superiores estén preservadas. Entonces, lo que ocurre es que un fármaco como la quimioterapia, que es el tratamiento que se utiliza de manera convencional para el cáncer, no llega muy bien al cerebro y no actúa tan bien en el cerebro como en otros sitios», señala Martínez.
En este sentido, el caso de la metástasis cerebral es único. «Las células cancerígenas que están en el tumor primario tienen que entrar en el torrente sanguíneo y al hacerlo irían a cualquier órgano del cuerpo. Algunas de ellas llegan a los vasos del cerebro y quedan atrapadas en los capilares cerebrales. Aquí empiezan las particularidades del cerebro. Lo primero que tiene que ocurrir es que esa célula cancerígena sea capaz de cruzar la barrera hematoencefálica, que es muchísimo más potente que cualquier otra en el cuerpo. Tiene múltiples capas, sus células están muy pegadas. Hace falta una serie de herramientas para que esa célula la atraviese», apunta Manuel Valiente.
Dentro del cerebro, adaptarse es más difícil para la célula cancerígena, ya que este órgano tiene varios mecanismos dedicados a conservar sus funciones y contener cualquier tipo de daño. Solo una de cada diez células logran esta adaptación, el resto mueren. «A medida que crecen, van a modificar el funcionamiento del cerebro. Secretan moléculas que tienen un impacto en la identidad defensiva de esas células del microambiente», explica Valiente.
Así, el sistema «empieza a funcionar ayudando a la metástasis a crecer, esto hace que eliminar una célula metastásica pronto sea mucho más fácil que eliminarla más tarde, porque más tarde tendrás que lidiar con un tumor mucho más grande que, además, tiene todo el ambiente que le rodea facilitándole el que siga proliferando. Las dificultades se multiplican», ilustra el experto.
El problema, como vemos, es que el mismo mecanismo que protege al cerebro haciéndolo hermético impide también que penetren en él de manera efectiva muchos tratamientos. La supervivencia en estos casos es, por lo tanto, muy limitada. Hasta hace poco, no superaba el año. Sin embargo, señala Martínez, hay esperanza. Las nuevas terapias dirigidas y la inmunoterapia han logrado, en muchos casos, conseguir que los pacientes sean «largos supervivientes», es decir, que vivan hasta cinco años después del diagnóstico.
Esto es importante, teniendo en cuenta que estas metástasis irán en aumento. «Antes no se hacía mucho caso a las metástasis cerebrales porque, como tenían un pronóstico tan malo, y los pacientes iban tan mal, ni la industria farmacéutica ni la academia investigaban mucho. Pero globalmente estamos viendo más metástasis cerebrales, porque los pacientes viven más, tienen más tiempo de desarrollar estas metástasis», señala Martínez.
